Итак, мы выяснили, что если атомы легко расстаются со своими внешними электронами, то эти электроны можно обобществить и образовать с их помощью металлический материал; если же одни атомы отдают свои электроны другим атомам, то образуются положительно и отрицательно заряженные ионы, которые, притягиваясь друг к другу, могут образовать ионный кристалл.
Но часто бывает, что ни один из взаимодействующих атомов не желает терять свои валентные электроны. Стремясь к выгодной конфигурации внешнего электронного слоя, атомы будут пытаться забрать электроны друг у друга. Если такое «перетаскивание электронного одеяла» приводит к устойчивому компромиссу между атомами, то говорят, что эти атомы связаны ковалентной связью. Очевидно, образование ковалентной связи более характерно для атомов неметаллов, так как атомы металлов не склонны вступать в борьбу за свои валентные электроны. В частности, атомы щелочных и щелочноземельных металлов из-за своей высокой активности вообще неспособны образовывать ковалентные связи в обычных условиях.
Интересно знать! Атомы металлов образуют ковалентные связи, как правило, тогда, когда не удаётся образовать связи других типов.
Ковалентная связь образуется вместо ионной, если катион металла имеет слишком большой заряд или слишком маленький размер: высокая плотность заряда на таком катионе позволяет ему «стаскивать» на себя рыхлое электронное облако аниона. Например, оксид алюминия Al2O3 плохо проводит ток в расплавленном состоянии, а это признак ковалентной связи. Жидкие при н.у. хлориды титана(IV) и олова(IV) совсем непохожи на соли и состоят из молекул с ковалентными связями металл-хлор. Тетраоксиды рутения и осмия также состоят из молекул и легко испаряются; именно резкий запах OsO4 дал название металлу осмию (от того же греческого слова όζω — «пахну» — получил своё название озон). Даже фтор порой идёт на компромисс с металлом: гексафторид вольфрама WF6 является газом при обычных условиях (кстати, рекордно тяжёлым), и его молекулы содержат ковалентные связи вольфрам-фтор.
Ковалентная связь образуется вместо металлической, если связано очень небольшое число атомов металла (чаще всего два). Например, в ацетате хрома(II) атомы хрома попарно соединены ковалентными связями:
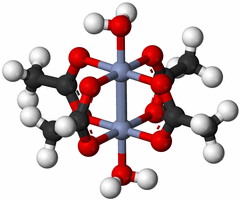
В многоатомных катионах ртути Hg22+ и Hg32+ также присутствуют ковалентные связи металл-металл.
Рассмотрим взаимодействие двух атомов водорода, обозначая электроны точками:
| H· | ·H |
У атома водорода внешний слой первый, и для его заполнения нужна всего одна электронная пара, то есть два электрона, располагающиеся на одной орбитали. Пока атомы водорода удалены друг от друга, каждое ядро взаимодействует лишь со «своим» электроном. Но если атомы станут ближе, то их электронные облака перекроются и каждое ядро будет взаимодействовать сразу с двумя электронами:
В результате одна и та же электронная пара охватывает сразу два атомных ядра и тем самым связывает их. Выглядит это примерно так:

Интересно знать! Оказывается, устойчивость такого связанного состояния атомов прямо следует из тождественности электронов. Строгое доказательство этого факта основано на решении квантовомеханических уравнений, однако суть можно пояснить и на словах. Так как электроны тождественны, для атома нет никакой разницы между «своим» и «чужим» электроном. Поэтому каждый атом «пользуется» общей электронной парой наравне с остальными орбиталями своего электронного облака.
Похожим образом взаимодействуют и атомы хлора. Каждый из них содержит на внешнем уровне семь электронов на четырёх орбиталях, то есть у каждого атома есть три электронные пары и один неспаренный электрон:
| .. | .. |
| : Cl · | · Cl : |
| ·· | ·· |
При перекрывании электронных облаков двух атомов хлора эти неспаренные электроны, как и в случае двух атомов водорода, образуют связывающую электронную пару (СЭП), которая соединяет атомы в молекулу Cl2:
| .. | .. |
| : Cl : Cl : | |
| ·· | ·· |
Формулы, в которых валентные электроны изображены точками, называются электронными формулами. Связывающие электронные пары в них располагают между химическими символами элементов, а валентные электронные пары, не принявшие участия в связывании, изображают снаружи и называют неподелёнными электронными парами (НЭП). В молекуле хлора у каждого атома остаётся три НЭП.
Таким образом, ковалентная связь реализуется благодаря образованию связывающих электронных пар, принадлежащих одновременно двум (или нескольким) атомам. Обычно СЭП охватывает два соседних атома, и в таком случае её обозначают чёрточкой, соединяющей химические символы:
Теперь можно понять и строение более сложных молекул. Например, в молекуле аммиака атом азота образует три общие электронные пары с атомами водорода, расходуя на это три электрона из пяти валентных:
| .. |
| H — N — H |
| | |
| H |
В результате атом азота окружён четырьмя электронными парами (достигнуто выгодное состояние), а каждый из атомов водорода пользуется одной электронной парой (для водорода это опять-таки выгодно).
Неподелённые электронные пары не принимают участия в связывании атомов, поэтому при изображении ковалентных связей НЭП обычно не указывают:
Формулы, в которых с помощью чёрточек и химических символов отражена последовательность соединения атомов ковалентными связями, называются структурными формулами.
Во всех рассмотренных примерах каждый атом окружает себя наиболее выгодным числом электронных пар (связывающих и неподелённых). Вообще говоря, при образовании ковалентных связей так происходит очень часто, поэтому можно предугадать, где и сколько образуется СЭП. Ведь число электронных пар, связывающих данный атом, есть валентность этого атома. Например, в молекуле аммиака атом азота трёхвалентен, а атомы водорода одновалентны. Нетрудно предсказать строение молекулы этана C2H6 на основании четырёхвалентности углерода и валентности водорода, равной единице:
| H | H | |
| | | | | |
| H — C | — | C — H |
| | | | | |
| H | H |
Как только атом образовал необходимое число связей, дальнейшие изменения его электронного облака становятся невыгодными. Эту принципиальную ограниченность числа электронных пар, связывающих определённый атом, называют насыщаемостью ковалентной связи. Благодаря этой особенности ковалентной связи существуют устойчивые многоатомные молекулы и ионы. Для металлической и ионной связи насыщаемость нехарактерна, поэтому металлические и ионные кристаллы растут неограниченно, но в случае ковалентной связи атомы могут собираться в небольшие устойчивые группы, сообща добиваясь более стабильного состояния своих электронных оболочек.
Другая важная особенность ковалентной связи — её направленность. Дело в том, что связывающие электронные пары определённым образом ориентированы в пространстве. А именно: СЭП располагаются так, чтобы лучше охватывать связываемые атомы и при этом не слишком сильно отталкиваться друг от друга (и от НЭП, если они есть). Например, в упомянутой молекуле аммиака они ориентированы вдоль воображаемых отрезков, соединяющих ядра атомов водорода с ядром атома азота. Угол, образованный подобными отрезками, называется валентным углом. В молекуле аммиака валентный угол H—N—H равен 107°:

Направленность и насыщаемость ковалентной связи приводят к тому, что атомы соединяются друг с другом не беспорядочно, а в некоторой последовательности, и располагаются в пространстве не случайным образом, а структурированно, образуя как молекулы определённой формы, так и бесконечные цепочки, слои или трёхмерные каркасы. Например, молекула белого фосфора имеет форму правильного тетраэдра, а кристалл графита построен из параллельных друг другу плоских шестиугольных сеток, в узлах которых сидят атомы углерода.
Особенности ковалентной связи наглядно иллюстрируются учебным набором для моделирования молекул: в шариках, представляющих атомы, заранее проделано определённое число отверстий под определёнными углами. Для соединения шариков используются палочки, что помогает увидеть в понятии «ковалентная связь» конкретность: ведь можно говорить о разных связях в одной и той же молекуле, указать, какие именно атомы связаны конкретной связью. Этого нельзя сделать для металлической или ионной связи: они имеют смысл как явление, характерное для вещества в целом, потому что ими связаны все частицы вещества сразу.
Первые представления о ковалентной связи и её особенностях были заложены в 1861 году Александром Михайловичем Бутлеровым и развиты в 1916 году Гилбертом Ньютоном Льюисом, а в середине XX века величайший вклад в изучение природы ковалентной связи и её характеристик внёс дважды нобелевский лауреат Лайнус Карл Полинг.