Периодический закон позволяет оценить многие свойства элемента по его положению в периодической системе, ведь именно таким образом Д. И. Менделеев когда-то предсказал химические свойства нескольких ещё не открытых элементов. Последуем примеру великого учёного и охарактеризуем элементы малых периодов, пользуясь информацией об их расположении в периодической системе.
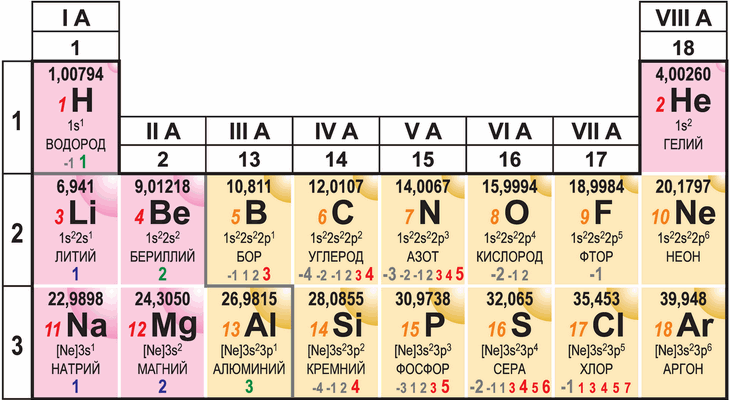
Водород, элемент №1. Он расположен в группе IA и начинает первый период. В атоме водорода всего один электрон, который находится на первом электронном слое маленького радиуса. Этот электрон должен легко принимать участие в химических взаимодействиях, поэтому электроотрицательность водорода невелика, а соединения разнообразны (именно водород является абсолютным рекордсменом по числу соединений, в состав которых входит). Но вместе с тем полностью отдавать электрон невыгодно, поэтому водород — неметалл. Валентность водорода равна единице, он образует оксид состава H2O, проявляющий амфотерные свойства (вода может реагировать и с кислотными, и с основными оксидами). Как и любой одновалентный неметалл, в простом веществе водород образует молекулы состава H2. Из-за рекордно малой массы этих молекул простое вещество является самым лёгким из всех газов.
Гелий, элемент №2. Он заканчивает первый период, потому что два электрона в атоме гелия завершают первый электронный слой, образуя очень устойчивое электронное облако, которому невыгодно изменяться под действием других атомов. Из-за этого химических соединений гелий не образует, а простое вещество состоит из одноатомных молекул, которые практически не взаимодействуют друг с другом и образуют при обычных условиях газ. Именно поэтому гелий относят к семейству благородных газов, помещая в группу VIIIA. Размер атома гелия рекордно маленький, что приводит к необычным квантовым эффектам в простом веществе. Например, гелий невозможно заморозить до твёрдого состояния при обычном давлении, вместо этого он превращается в сверхтекучую жидкость. Очевидно, гелий — неметалл.
Литий, элемент №3, начинает второй период и попадает в группу IA. В его атоме три электрона, два из которых образуют внутренний первый слой, а третий электрон находится уже на втором слое и является валентным. При потере этого электрона получается «благородное» электронное облако, аналогичное гелиевому, поэтому атом лития легко теряет электрон, приобретая положительный заряд и превращаясь в ион Li+. По этой причине литий — типичный металл, причём одновалентный и весьма активный. Он относится к щелочным металлам, поскольку образует основный оксид состава Li2O и сильное основание (щёлочь) состава LiOH. Простое вещество — блестящий металл, который из-за высокой активности быстро окисляется на воздухе, а из-за маленькой атомной массы лития имеет рекордно низкую плотность (ниже, чем у многих сортов дерева).
Бериллий, элемент №4, находится в группе IIA, атом содержит два электрона на внешнем слое. Это достаточно мало для того, чтобы быть металлом, но при этом бериллий имеет наименьший среди всех металлов атомный радиус: сказывается расположение во втором периоде. Бериллий находится непосредственно возле границы с неметаллами, поэтому его оксид состава BeO, как и гидроксид Be(OH)2, проявляет амфотерные свойства. Простое вещество представляет собой довольно прочный и вместе с тем лёгкий металл, однако его применение ограничено из-за сильной токсичности соединений бериллия и высокой стоимости металла.
Бор, элемент №5, попадает в группу IIIA, так как в его атоме на внешнем слое находится три электрона. Небольшой атомный радиус не позволяет легко терять эти электроны, поэтому бор является неметаллом. В то же самое время его электроотрицательность ещё мала для неметалла (всего 2 балла по шкале Полинга), поэтому он химически малоактивен. Простое вещество представляет собой очень твёрдые буровато-серые частицы, а кислотному оксиду состава B2O3 соответствует борная кислота H3BO3, настолько слабая, что её водный раствор можно закапывать в глаза.
Углерод, элемент №6, находится в группе IVA и имеет ровно наполовину заполненный внешний слой (4 электрона из 8 возможных). Малая величина атомного радиуса и заметная электроотрицательность позволяет углероду окислять большинство металлов и даже водород, образуя с ним летучее соединение состава CH4 (метан), то есть углерод уже является типичным неметаллом. С кислородом он образует оксид состава CO2, проявляющий кислотные свойства и отвечающий слабой угольной кислоте H2CO3. Простые вещества, образованные углеродом, отличаются от элемента названиями и проявляют ряд особых свойств. Например, графит — самое жаропрочное из простых веществ, а алмаз обладает рекордной твёрдостью и теплопроводностью.
Азот, элемент №7, расположен в группе VA в соответствии с пятью электронами на внешнем слое. До выгодного состояния не хватает всего трёх электронов, а атомный радиус азота уже очень мал, поэтому его электроотрицательность высока. Даже кислороду становится трудно окислить азот, поэтому высший оксид состава N2O5, как и соответствующая ему сильная азотная кислота HNO3, уже не очень стабильны в сравнении с низшими оксидами. С водородом азот образует летучее соединение NH3 (аммиак). Из-за маленького радиуса атомы азота предпочитают соединяться друг с другом в прочные двухатомные молекулы N2, поэтому в форме простого вещества азот представляет собой газ очень низкой химической активности.
Кислород, элемент №8, занимает первое место по распространённости в земной коре и потому рассматривается особо. Принадлежность к группе VIA говорит о наличии на внешнем слое шести электронов из восьми возможных, а ещё меньший, чем у азота, атомный радиус позволяет с лёгкостью дополнять внешний слой двумя недостающими электронами, поэтому кислород, как правило, двухвалентен. По электроотрицательности он проигрывает лишь фтору и переводит в оксиды почти все элементы периодической системы, в том числе водород, образуя с ним летучее соединение H2O. Сам с собой кислород способен соединяться в двухатомные молекулы O2 (простое вещество кислород) и трёхатомные молекулы O3 (простое вещество озон). Оба простых вещества — газы, но озон намного активнее из-за более слабой связи между атомами кислорода в его молекулах. Необычное электронное строение молекулы озона придаёт этому газу синюю окраску.
Фтор, элемент №9, является первым представителем семейства галогенов, находясь в группе VIIA. Его атомный радиус ненамного превышает радиус атома водорода, а до устойчивого восьмиэлектронного состояния внешнему слою не хватает всего лишь одного электрона. Поэтому фтор — наиболее электроотрицательный элемент: соединяясь с другими элементами, он переводит их во фториды, проявляя валентность, равную единице. Даже с кислородом образуется не оксид, а фторид состава OF2; с водородом образуется летучее соединение HF, которое проявляет свойства кислоты (водный раствор HF называют плавиковой кислотой). Фтор, как и водород, является одновалентным неметаллом и поэтому образует в простом веществе двухатомные молекулы F2 (по причине такого сходства водород когда-то даже помещали в одну группу с галогенами). Связь в молекуле F2 малопрочная, поэтому химическая активность фтора очень высока: в нём способны гореть даже стекло и вода.
Неон, элемент №10, завершает второй период и относится к группе VIIIA. Внешний электронный слой в его атоме имеет рекордно высокую плотность: атомный радиус ненамного превышает радиус атома гелия, а электронов на внешнем слое в четыре раза больше. Поэтому неон принципиально не способен образовывать химические соединения и является наиболее инертным из всех благородных газов. Простое вещество, как и в случае гелия, состоит из одноатомных молекул, почти не взаимодействующих друг с другом, поэтому температуры плавления и кипения неона очень низки.
Натрий, элемент №11, начинает третий период в системе Менделеева, поскольку первый и второй слой заполнены десятью электронами, как в атоме неона, и одиннадцатому приходится идти дальше. В результате внешний слой в атоме натрия — третий, и на нём находится единственный валентный электрон, поэтому натрий является полным аналогом лития и относится вместе с ним к группе IA. Так же, как и литий, натрий является щелочным металлом, проявляет высокую химическую активность, образует основный оксид Na2O и щёлочь NaOH, только всё это выражено в большей степени, чем у лития, благодаря большему атомному радиусу и меньшей электроотрицательности натрия. Из-за возросшей атомной массы плотность металлического натрия выше, чем лития, но всё ещё меньше плотности воды.
Магний, элемент №12, является аналогом бериллия, попадая в группу IIA. Из-за большего радиуса атом магния теряет пару внешних электронов легче, чем атом бериллия. Поэтому металличность магния выражена ярче: оксид MgO является основным, а гидроксид Mg(OH)2, хоть и не является щёлочью, уверенно проявляет основные свойства (например, вытесняет аммиак из солей аммония). Простое вещество уже не так устойчиво на воздухе, как бериллий: металлический магний легко поджигается и ярко сгорает, благодаря чему использовался в фотовспышках. При этом магний способен гореть под водой, в атмосфере углекислого газа и даже в атмосфере азота, чем напоминает расположенный по диагонали литий.
Алюминий, элемент №13, принадлежит группе IIIA периодической системы, как и элемент бор. Однако, в отличие от бора, алюминий является металлом, поскольку больший радиус позволяет его атомам терять все три валентных электрона. Высшие кислородные соединения алюминия — оксид Al2O3 и гидроксид Al(OH)3 — проявляют амфотерные свойства (диагональное сходство с бериллием), причём оксид алюминия химически малоактивен. Но в форме простого вещества алюминий очень пластичен, имеет высокую тепло- и электропроводность, то есть является типичным металлом, причём достаточно активным для того, чтобы восстанавливать большинство других металлов из их оксидов.
Кремний, элемент №14, является аналогом углерода, продолжая группу IVA. Четвёрка валентных электронов слабее, чем в атоме углерода, держится на внешнем слое, а до выгодного 8-электронного состояния ещё далеко, поэтому кремний является «слабым» неметаллом, как и расположенный по диагонали бор. Высший оксид SiO2 химически очень стоек (из него делают химическую посуду), а соответствующая ему кислота H2SiO3 даже слабее борной. С водородом кремний даёт летучее соединение SiH4 (силан), которое воспламеняется на воздухе и ядовито. Кремний образует твёрдое тёмно-серое простое вещество со стеклянным блеском, широко используемое в микроэлектронике.
Фосфор, элемент №15, относится к группе VA третьего периода и является химическим аналогом азота. Пять электронов на внешнем слое атома фосфора удерживаются намного слабее, чем в атоме азота, из-за большего атомного радиуса, поэтому фосфор не так ярко, как азот, проявляет неметаллические свойства. Но всё же он переводит многие металлы в фосфиды, а также образует с водородом летучее соединение PH3 (фосфин, сильнейший яд с неприятным запахом). Высший оксид фосфора P2O5 кислотный, ему соответсвует фосфорная кислота H3PO4 средней силы. Друг с другом атомы фосфора образуют молекулы белого фосфора состава P4 (аналогичные молекулам азота частицы P2 существуют лишь при высоких температурах). Фосфор также образует простые вещества немолекулярного строения: например, чёрный фосфор имеет слоистую структуру, напоминающую графит (диагональное сходство с углеродом), а строение красного фосфора, который используется для производства спичек, ещё сложнее.
Сера, элемент №16, находится под кислородом в группе VIA и наследует некоторые его свойства. Так же, как и кислороду, типичному неметаллу сере не хватает двух электронов до устойчивого состояния внешнего электронного слоя, поэтому сера чаще всего двухвалентна и образует с большинством элементов сульфиды, аналогичные по составу оксидам. Например, с водородом сера образует летучее соединение H2S; из-за большего размера атома серы связь с водородом менее прочна, поэтому, в отличие от воды, сероводород проявляет слабые кислотные свойства. Высшему оксиду серы SO3 соответствует сильная кислота H2SO4; низший оксид серы, однако, устойчивее, и в этом проявляется некоторое сходство с расположенным по диагонали азотом. Друг с другом атомы серы предпочитают соединяться в кольца S8 или бесконечные цепи, а аналогичные молекулам кислорода частицы S2 сера образует только при высоких температурах.
Хлор, элемент №17, является вторым представителем семейства галогенов и во многом копирует свойства фтора. Атомам хлора также не хватает одного электрона до выгодного состояния внешнего слоя, поэтому хлор является типичным неметаллом, предпочитающим валентность, равную единице. Несмотря на больший, чем у фтора, атомный радиус, хлор имеет высокую электроотрицательность, проигрывая лишь кислороду со фтором, и с большинством элементов образует хлориды. С водородом хлор даёт HCl — летучее соединение, проявляющее намного более сильные кислотные свойства, чем HF, из-за более слабой связи с атомом водорода. Кислород оказывается способным перевести хлор в высший оксид Cl2O7, которому отвечает сильнейшая кислота HClO4 (хлорная). Простое вещество Cl2, как и фтор, представляет собой газ из двухатомных молекул, но по химической активности хлор заметно уступает фтору.
Аргон, элемент №18, завершает третий период системы Менделеева, поскольку в его атоме достигнуто устойчивое состояние внешнего электронного слоя (8 электронов). Так же, как и неон, аргон является благородным газом и относится к группе VIIIA, образуя химически инертное простое вещество из одноатомных молекул. Его атомный радиус существенно больше, чем у неона, что в принципе позволяет атомам аргона образовывать химические соединения, однако все они очень нестабильны.
Интересно знать! В больших периодах появляются новые интересные закономерности и явления: вторичная и внутренняя периодичность, d- и f-сжатие, релятивистские эффекты и многое другое. Если вы познакомитесь с этими тонкостями периодического закона в университете, вы сможете объяснить, например, почему медь и золото окрашены, а серебро — нет; почему ртуть жидкая, а вольфрам имеет рекордную температуру плавления; почему золото растворяется в селеновой кислоте, но не растворяется в серной; почему неодимовые магниты такие сильные и почему палладий растворяет такие огромные объёмы водорода. Но на этом не стоит останавливаться: ведь именно глубокое понимание природы химических элементов позволяет изобретать новые материалы и двигать вперёд современные химические технологии. Периодический закон — фундамент химии, а в фундаментальной науке наше будущее и наш успех.