В формулировке периодического закона не говорится о том, какие именно свойства периодически зависят от заряда ядра. Дело в том, что химическое описание элемента и его соединений включает множество свойств и характеристик, поэтому перечислить их все довольно трудно. Рассмотрим некоторые из них, наиболее важные, ограничиваясь при этом элементами A-групп.
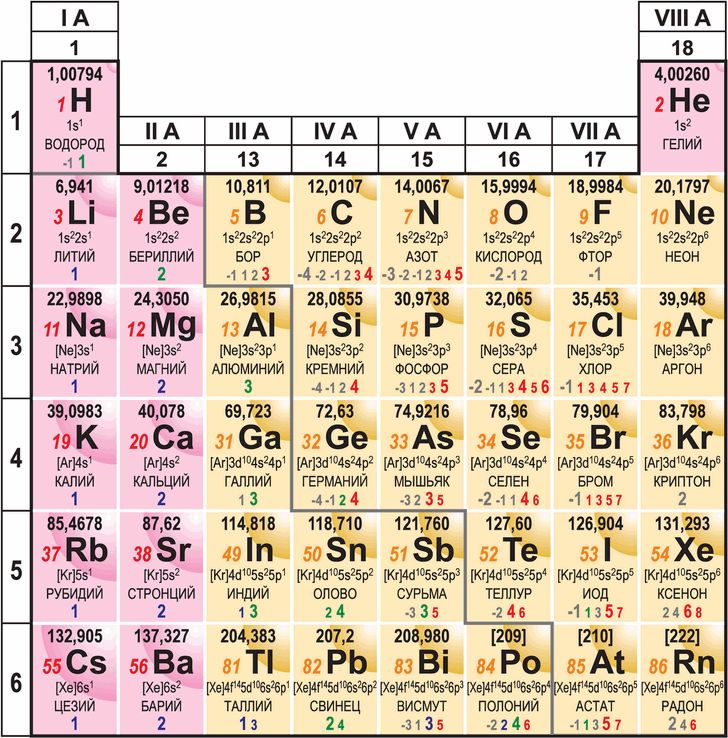
Атомный радиус r — это величина, характеризующая размер атома. Чем больше атомный радиус, тем дальше от ядра простирается его электронное облако. Большинство атомов имеют радиусы в пределах 0.05 — 0.2 нанометра (нм); самым маленьким является атом гелия (r < 0.04 нм), а самым большим — атом цезия (r > 0.23 нм).
Интересно знать! Электронное облако атома не имеет чётких границ, а значит, и точных размеров, поэтому величина атомного радиуса является условной и зависит от метода определения. Например, можно рассмотреть сферу с центром в атомном ядре и рассчитать, какая часть электронного облака свободного атома окажется внутри сферы в зависимости от радиуса этой сферы. Последняя точка перегиба на графике этой зависимости будет соответствовать орбитальному радиусу атома. С другой стороны, можно подобрать такие значения радиусов, чтобы расстояние между соседними атомными ядрами в молекулах соответствовало сумме этих радиусов; так получаются ковалентные радиусы атомов (именно они указаны на рисунке). Есть и другие способы определения атомных радиусов, но важно понимать, что для сравнения атомных радиусов друг с другом нужно брать значения, определённые одним и тем же методом.
На рисунке атомный радиус обозначен сектором в правом верхнем углу каждой клетки. Видно, что в пределах группы атомный радиус увеличивается сверху вниз. Это объясняется тем, что элементы одной группы отличаются числом электронных слоёв, а чем их больше, тем больше размер атома. С другой стороны, в пределах периода атомный радиус уменьшается слева направо. Это происходит потому, что заряд ядра слева направо растёт и внешний электронный слой всё сильнее «прижимается» к ядру.
Электроотрицательность χ — это условная величина, характеризующая способность атома уплотнять своё электронное облако при взаимодействии с другими атомами. Когда атомы связываются друг с другом, их электронные облака перекрываются и деформируются так, чтобы взаимодействие с ядрами было наиболее выгодным, то есть происходит перераспределение электронной плотности. При этом оказывается, что какие-то атомы «тянут» сильнее, скапливая вокруг себя избыточный отрицательный заряд, — отсюда и название величины. Впервые численные оценки этой величины предложил известный химик Лайнус Карл Полинг, и с тех пор электроотрицательность оценивают в баллах по шкале Полинга. Самый «сильный» по электроотрицательности элемент — фтор, самый «слабый» — цезий:

Электроотрицательность определяется тем, насколько выгодно атому уплотнять своё электронное облако. Это зависит от атомного радиуса: чем больше размер атома, тем дальше от ядра оказываются принимаемые атомом электроны и тем менее выгоден их приём. Именно поэтому электроотрицательность в пределах группы уменьшается сверху вниз. Но ещё важно, насколько близок внешний слой к выгодному состоянию (обычно 8 электронов, но для первого периода 2): чем меньше электронов нужно для этого принять, тем слабее они отталкиваются друг от друга и тем выгоднее процесс приёма. По этой причине электроотрицательность в пределах периода увеличивается слева направо. Усиливает эту тенденцию и сопутствующее уменьшение атомного радиуса.
Интересно знать! У атомов благородных газов уже достигнуто наиболее выгодное состояние внешнего слоя, поэтому для них понятие электроотрицательности не имеет чёткого смысла. Именно по этой причине благородные газы отсутствуют в приведённом выше эмпирическом ряду. Также оттуда исключены элементы седьмого периода, большая часть которых малоизучена. Кроме того, заряд ядра в атомах элементов 7 периода настолько велик, что возникают отклонения от закономерностей, наблюдающихся в предыдущих периодах (например, у франция атомный радиус меньше, а электроотрицательность выше, чем у цезия). Причинами этих отклонений являются спин-орбитальное расщепление и релятивистские эффекты, которые изучаются в университетском курсе квантовой химии.
Металличность — это качественная характеристика элемента, отражающая стремление его атомов приобретать положительный заряд. Атомы металлов легко расстаются со своими внешними электронами, слабо связанными с ядром; атомы же неметаллов не склонны отдавать электроны, потому что у них связь с ядром крепче. С увеличением атомного радиуса эта связь ослабевает, поэтому в пределах группы металличность усиливается сверху вниз. Важно и то, сколько электронов находится на внешнем слое: чем их больше, тем больше положительный заряд под внешним слоем и тем труднее электронам с ним расстаться. В результате в пределах периода металличность ослабевает слева направо. С учётом этих двух тенденций граница между металлами и неметаллами оказывается близкой к диагонали водород-астат; она изображена серой линией на рисунке в начале параграфа.
Интересно знать! Металличность можно противопоставить электроотрицательности в том смысле, что металличность характеризует способность «отдавать» электроны, а электроотрицательность — способность их «забирать». Но эти понятия не являются противоположными друг другу. Например, у благородных газов металличность вообще не выражена, но принимать электроны они не способны. Другой пример: полоний является металлом (из-за большого атомного радиуса), но его электроотрицательность заметно выше, чем у неметалла кремния (до выгодного состояния внешнего слоя полонию не хватает всего двух электронов).
Таким образом, вдоль таблицы Менделеева:
- атомный радиус и металличность увеличиваются налево и вниз, к цезию, который является наиболее типичным металлом и имеет наибольший размер атомов;
- электроотрицательность увеличивается направо и вверх, ко фтору, способному «забрать» электроны у любого другого соединяющегося с ним элемента.