Если мы зафиксируем числа A, Z и не будем принимать во внимание внутреннюю структуру атомного ядра, то получим определённую разновидность атомов, то есть определённый нуклид. Не следует путать понятия «нуклид» и «нуклон»: оба слова произошли от латинского «nucleus» — «ядро», но нуклон — это частица в составе ядра, а нуклид — это вид атомов с заданным составом ядер (Z протонов, N нейтронов).
Химическая природа атома задаётся электронным облаком, а его состав зависит только от заряда ядра, то есть от числа Z. Поэтому все атомы одной химической природы имеют одинаковый заряд ядра. Следовательно, химический элемент — это совокупность атомов с заданным значением заряда ядра Z. Именно поэтому число Z было названо атомным номером, так как в таблице Менделеева элементы упорядочены по возрастанию Z.
Если нуклиды отличаются массовым числом A, но имеют один и тот же атомный номер Z, то они имеют одинаковую химическую природу, принадлежат одному и тому же элементу и являются изотопами этого элемента. Чтобы обозначить конкретный изотоп, к химическому символу элемента приписывают слева вверху число A, например:
| Химический элемент водород | ||
| протий | дейтерий | тритий |
| 1H | 2H или D | 3H или T |
| Z=1 | Z=1 | Z=1 |
| N=0 | N=1 | N=2 |
| A=1 | A=2 | A=3 |
Как видно из таблицы, природный водород существует в виде трёх изотопов, причём для дейтерия и трития есть даже собственные химические символы.
Но не всякий набор протонов и нейтронов может дать устойчивое атомное ядро. Бывает, что ядро способно самопроизвольно распадаться, превращаясь в другое ядро. Такое явление называется радиоактивностью, а процесс распада обычно сопровождается излучением — радиацией.
| Нуклиды: | |
| стабильные | радионуклиды |
| (всего около 250) | (их более 3000) |
Уравнения радиоактивного распада записываются подобно уравнениям химических реакций. Например, атом трития распадается на ион гелия-3, электрон и особую частицу, которая называется электронное антинейтрино:
3H → 3He+ + e— + νe
Однако следует помнить, что радиоактивный распад не является химическим процессом, поскольку при нём происходят взаимные превращения атомных ядер.
Большинство радионуклидов в природе не встречается и получено искусственно. Их устойчивость обычно характеризуется периодом полураспада t1/2 — интервалом времени, в течение которого вероятность распада ядра достигает 50%. Период полураспада может составлять от триллионных долей секунды до многих триллионов лет.
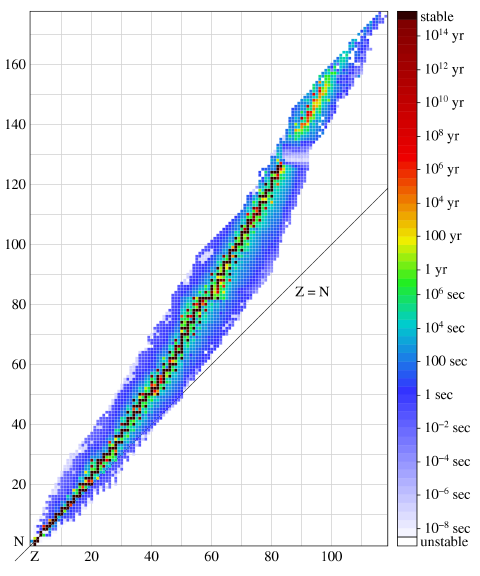
На данном рисунке приведена диаграмма нуклидов, где в координатах (Z, N) отображены известные нуклиды; цвет квадратика зависит от устойчивости нуклида в соответствии со шкалой периодов полураспада справа. Каждый столбик этой диаграммы соответствует определённому значению Z и представляет набор изотопов одного химического элемента.
Интересно знать! Узкая цепочка наиболее стабильных нуклидов соответствует оптимальному соотношению нейтронов и протонов в ядре. Для заданного массового числа оно может быть выражено формулой
N/Z = 1 + 0.015 A2/3
Для небольших значений массового числа A соотношение N/Z получается близким к единице, поэтому среди первых элементов распространены изотопы, у которых N = Z. Однако затем нейтронов становится больше, и, например, у стабильных изотопов свинца их число превышает число протонов примерно в полтора раза.
Изотопы одного химического элемента имеют одинаковые химические свойства, поэтому их невозможно отличить химическим путём. В природе очень редки процессы, затрагивающие атомные ядра, и разные изотопы одного и того же элемента ведут себя одинаково в природных условиях, образуют одни и те же соединения и таким образом перемешиваются друг с другом. В результате соотношение изотопов практически не зависит от месторождения, из которого получен элемент, и оказывается примерно одинаковым по всей планете. Это соотношение изотопов называется природным изотопным составом данного элемента.
| Природный хлор | |
| 35Cl | 37Cl |
| m = 35 а.е.м. | m = 37 а.е.м. |
| 76% атомов Cl | 24% атомов Cl |
| mсредн. = 35·0,76 + 37·0,24 = 35,5 а.е.м. | |
Атомы разных изотопов имеют разные массы, но постоянство изотопного состава приводит к тому, что усреднённое значение массы атома данного элемента также постоянно. Именно это усреднённое по природным изотопам значение, выраженное в атомных единицах массы (а.е.м.), есть относительная атомная масса Ar данного элемента. В таблице Менделеева относительные атомные массы приведены для элементов, получаемых из природных источников.
Число Авогадро (6,02·1023) атомных единиц массы в точности равно одному грамму, поэтому если масса какой-либо частицы в среднем равна Ar атомных единиц, то масса одного моля таких частиц составит Ar грамм. Например, m(1 моль атомов Cl) = 35,5 г.
Масса конкретного атома, выраженная в а.е.м., очень близка к его массовому числу A, так как масса одного нуклона примерно равна 1 а.е.м., а всего в атоме A нуклонов. Поэтому если в природе преобладает какой-то один изотоп данного элемента, то величина Ar этого элемента будет близка к массовому числу преобладающего изотопа. Именно поэтому относительные атомные массы многих элементов близки к целым числам. Однако не следует путать величины A и Ar: число A характеризует конкретный нуклид и указывает, сколько нуклонов в его ядре, а число Ar характеризует совокупность природных изотопов химического элемента и указывает усреднённое значение массы атома данного элемента в а.е.м.
Интересно знать! Точность величины Ar зависит от постоянства изотопного состава элемента. Натрий в природе представлен одним изотопом, поэтому никакой разбежки быть не может и Ar(Na) = 22,98976928 (все восемь знаков после запятой верны). Олово же представлено десятью изотопами; содержание каждого из них может варьироваться, поэтому Ar(Sn) = 118,710. Изотопы свинца постоянно образуются при радиоактивном распаде тяжёлых элементов, поэтому Ar(Pb) = 207,2. Для искусственно получаемых элементов величина Ar не имеет смысла, и в таких случаях вместо неё указывают в квадратных скобках массовое число самого долгоживущего из известных изотопов.